ゲノム医療では、患者の個々の遺伝子変異(※1)に対して病原性の有無を知ることが重要である。患者の遺伝子に病原性のある変異を見つけることができれば、その変異に対して治療法を検討することができる。しかし、膨大な遺伝子変異のうち疾患への関連性が明らかになっている変異はごく一部にすぎない。病原性の有無が未知の遺伝子変異からは、疾患の治療に役立つ情報を得ることができていないことが課題となっている。
富士通株式会社と国立大学法人京都大学 大学院医学研究科の奥野恭史教授らの研究グループは、2016年11月より、国立研究開発法人日本医療研究開発機構が推進する「臨床ゲノム情報統合データベース整備事業(※2)」に参画し、医療従事者や研究者による遺伝子変異の検討作業をAIで支援するための研究開発に取り組んできた。
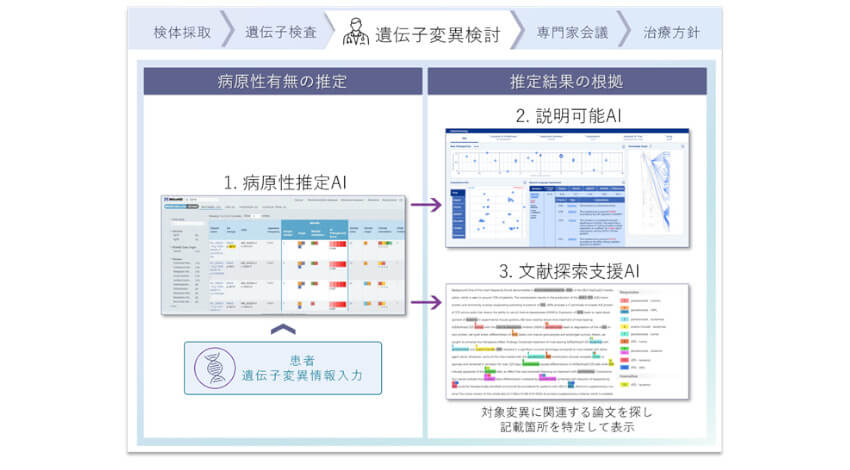
このほど、富士通と京都大学は、特定の遺伝子変異が何らかの疾患の原因になる可能性(以下、病原性)の有無を推定し、その推定根拠を添えて治療方針を検討する医師やゲノム医療の研究者に示すことができるAIを活用した検証システム「MGeND Intelligence」を開発した。
同システムは、遺伝子変異の病原性の有無を推定できる病原性推定AI、推定の根拠を示す説明可能AI、関連する論文記載の検索を支援する文献探索支援AIから構成される。京都大学が2018年に公開した臨床ゲノム情報統合データベース「MGeND」と連携し、病原性の有無が未知の変異も含めて医療従事者や研究者による遺伝子変異の調査・臨床的解釈の作業を支援する。詳しい特長は以下の通り。
- 遺伝子変異の病原性の有無を推定
- 医療従事者や研究者が理解しやすい推定根拠を自然文で説明
- 病原性を判断する根拠となる論文の調査を支援
病原性の有無がわかっている遺伝子変異に関連する公共データベースの情報をもとに、機械学習の教師データとなる遺伝子変異ナレッジグラフ(※3)を構築した。
ナレッジグラフの構築では、京都大学奥野恭史教授らのグループによって推定に有効なグラフ範囲を定め、機械学習に株式会社富士通研究所が開発したグラフ構造(※4)データを学習する技術「Deep Tensor」(※5)を用いることで、遺伝子変異に対して病原性の有無を推定できるAIを実現した。
Deep Tensorを用いた推定では、ナレッジグラフ上で推定に大きく寄与したグラフノード(以下、推定因子)を示すことができるという特徴がある。しかし、病原性の判定は複数の根拠をもとに総合的に行われるため、ナレッジグラフ上で推定根拠となった部分を示すだけでは病原性推定の説明として十分ではなかった。
そこで今回、どのような説明をすればAIによる病原性推定の結果を信頼できるかについて、奥野教授らのグループおよびゲノム医療の研究者へヒアリングを行い、複数の説明パターンを抽出した。その上で、Deep Tensorで得られる推定因子から各説明パターンの適合する度合いを計算し、その度合いの高い複数のパターンをもとに推定根拠を説明する文章を生成する。医療従事者や研究者は推定根拠の説明文を一読するだけで、推定に大きく寄与した重要な根拠を把握することが可能だという。
大量の論文から対象とする変異と任意疾患との関係を記述している部分を検索し、論文中の該当部分をハイライトして表示する。関連情報を調べるために、例えば、大量の文献から変異と薬剤との関係性を記述した文章だけを明示的に表示することも可能だ。これにより、過去論文に含まれている推定根拠を容易に調べることができ、既知の事実に基づく推定結果の検討時間を短縮できる。
今回、東京大学医科学研究所 ヒトゲノム解析センターの協力のもと、遺伝性疾患治療を題材に、未知変異(※6)について病原性推定から根拠獲得まで病原性推定システム全体の評価試験を行い、臨床面の観点からの示唆をシステムに反映させた。その結果、いずれの変異に対しても病原性の推定結果は妥当であり、根拠を説明する文章も専門医から見て適切なものとなったことを確認したという。
例えば、今回検証したある変異では、評価試験で用いたシステム構築時には病原性が未知で、その後、病原性ありと判定された変異だが、病原性推定AIは「病原性あり」と正しく推定することができた。また、評価者はAIが生成した説明文を読むことで、AIによる推定根拠の概要を把握した上で病原性ありと考えるのに十分な根拠を集めることができた。
今後富士通では、今回の成果をもとに説明機能のさらなる充実を図り、電子カルテを主とした病院情報システムにおけるゲノム医療を支援する機能を新規開発し、全国の中核拠点及び拠点病院、連携病院への導入を目指す。また、京都大学は2021年4月より、共同研究者や協力機関などに対して同システムの利用提供を予定している。
※1 遺伝子変異:遺伝子の多様性のこと。ここでは便宜上、集団内に一定以上の割合で存在する疾患に関係しない遺伝子多型を含め、「遺伝子変異」という表現を用いる。
※2 臨床ゲノム情報統合データベース整備事業:政府のゲノム医療実現推進協議会 中間とりまとめを踏まえ、ゲノム情報と疾患特異性や臨床特性などの関連について日本人を対象とした検証を行い、臨床および研究に活用することができる臨床情報と遺伝情報を統合的に扱うデータベースを整備するとともに、その研究基盤を利活用した先端研究開発を一体的に推進する事業。
※3 ナレッジグラフ:論文や研究成果といった形で表現される情報を集め、互いに関連するもの同士を接続したグラフ構造の集合体で計算機で扱う知識を格納するために使われる。
※4 グラフ構造:ノード(点)をエッジ(線)で接続した形状として表現される情報で、代表的な知識表現形式のひとつ。
※5 Deep Tensor:人やモノのつながりを表現できるグラフ構造のデータに対して解析が可能な富士通独自の機械学習技術。
※6 未知変異:評価に用いたシステムに搭載されているAI推定のモデル構築時点で病原性の有無が不明だった遺伝子変異で、現在は病原性の有無が判明しているもの。
プレスリリース提供:富士通